Теория и практика активации работы электрокоагулятора с объемными анодами
Аннотация
Описан процесс очистки сточных вод гальванического производства с помощью электрокоагулятора с объемными анодами. Проанализирован химизм процесса пассивации и депассивации в металлических стружках.
Ключевые слова: водоочистка, сточные воды гальванического производства, активация, электрокоагулятор, электрод, пассивация
05.23.04 - Водоснабжение, канализация, строительные системы охраны водных ресурсов
Для очистки сточных вод гальванических производств наиболее интересным является электрохимический метод.Изучение опубликованных данных по электрокоагуляции показывает, что этим вопросам уделялось мало внимания и с теоретической и с практической сторон [1].
Для снижения стоимости очистки сточных вод были предприняты попытки использования стружечных электродов. Большую сложность при использовании металлической стружки представляют постоянная пассивация металла и засорение контактных зон диэлектрическим шламом.
Переход железа в пассивное состояние сопровождается образованием на его поверхности оксидных или солевых пассевирующих пленок. Пассивирующий в кислой среде металл – сложная физико-химическая система, включающая активную металлическую поверхность, растворяющуюся при высоких плотностях тока.
Начальная стадия депассивации, приводящая к резкому росту анодного тока, не связана с перфорацией пленки и обнажением металла. На этой стадии, по-видимому, происходит лишь более или менее равномерное уменьшение толщины пленки [2].
На электроде после его самопроизвольной активации значительная часть поверхности остается покрытой пленкой. Для полного удаления ее требуется катодная поляризация.
Взаимодействие поверхности пассивирующего оксида с агрессивными анионами Ап- и молекулами воды Н2О описывается двумя параллельными реакциями:
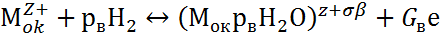 |
(1) |
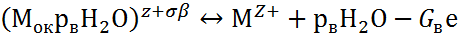 |
|
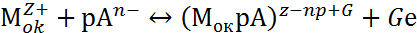 |
(2) |
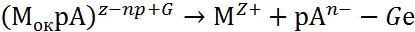 |
где Мок – поверхность пассивирующего оксида; р, рв, G, Gв – стехиометрические коэффициенты.
Было предложено [3,4], чтоагрессивные анионы и молекулы воды адсорбционно взаимодействуют с поверхностью пассивирующего слоя и непосредственно участвуют в актах перехода металлических ионов оксидов в раствор. Поверхность металла считалась однородной.
На первых стадиях процессов (1, 2) происходит заполнение электрода промежуточными комплексами, ионизация которых на необратимых стадиях определяет ток растворения запассивированного металла.Если пленка достигнет предельной дефектности, стабильное существование оксида становится невозможным, происходит депассивация. Так как поверхность металла неоднородна, то предельная дефектность различных ее участков достигается при неодинаковых потенциалах.
В отсутствие агрессивных анионов процесс локальных депассиваций обратим, поскольку в ходе растворения возможно уменьшение активности локально депассивированных участков. В присутствии агрессивных анионов (в частности, хлорид-анионовCl-) локальная депассивация необратима. Это связано с заполнением локально обнажившихся участков поверхности металла хлоридными комплексами по реакции:
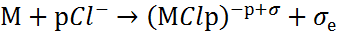 |
(3) |
Хлоридные комплексы оттесняют молекулы воды и делают невозможным пассивационный процесс. Отрицательно заряженные хлоридные комплексы взаимодействуют с соседними диполями воды, образуя поверхностные комплексы:
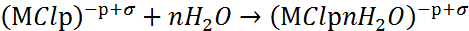 |
(4) |
Поверхностные комплексы способны переходить в раствор по схеме:
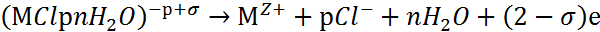 |
(5) |
Все три стадии (3-5) необратимы. Ионы Cl- и молекулы воды регенерируют по схеме (5) и вновь участвуют в элементарном акте, а ионы металла отводятся на периферию.
Согласно рассматриваемой теории потенциал питтингообразования зависит от концентрации агрессивных ионов как:
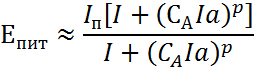 |
где СА – концентрация агрессивных ионов, а – подгоночный параметр, оцениваемый из сравнения теории с экспериментом.
Изотопным методом доказано, что поверхность пассивного железа в хроматных растворах прочно связывает заметные количества хрома. На основании этого высказывались предположения о том, что адсорбция ионов CrO4-2 сопровождается их восстановлением до низших оксидов хрома, которые изменяют химический состав и свойства пассивирующей пленки [4]. Подробное изучение электрохимических характеристик пассивности железа в кислых хроматных растворах показало, что они почти совпадают с теми же величинами в отсутствие CrO4-2, но резко отличаются от соответствующих характеристик пассивного хрома. Судя по этим данным, происходит лишь абсорбция – насыщение пленки анионами CrO4-2 – процесс, хорошо известный для анодных оксидных пленок.
Специфическое влияние на анодную пассивационную пленку железа оказывают ионы ClO4-. При депассивации в хлорной кислоте происходит рост тока, однако он носит характер резкого скачка: ток возрастает на 1-2 порядка. Затем следует область сильных произвольных флуктуаций тока, которая сменяется новым резким подъемом, ведущей к полной депассивации. Вызванная анионами ClO4- дестабилизация пассивирующей пленки становится возможной после начала ее восстановления. В 0,5 МНClO4 этот эффект выражен сильнее, чем в 1,0 МНClO4.
В сульфатных растворах поверхность пор наружного слоя оксида Fe(III) заряжена отрицательно, благодаря чему при анодной поляризации электролит выталкивается из пор, освобождая их, что препятствует питтингообразованию. Введение в раствор ионов Cl- и их миграция в воде при определенной пороговой их концентрации приводит к вытеснению анионов SO42-. Это вызывает перезарядку оксида Fe(III) и появления в порах осмотического потока, направленного к электроду. Если рН<5,8, осмотический поток этого же направления возникает и в порах внутреннего слоя пленки, в результате чего раствор хлорида достигает поверхности железа, вызывая питтинг. С увеличением рН вследствие повышения отрицательного заряда поверхность пор внутреннего слоя пленки изменяется.
Растворимые продукты электролиза изменяют в основном протолитические и окислительно-восстановительные свойства раствора, которые, в свою очередь, изменяют энергетическое состояние примесей При электролизе возможны различные направления изменения величины рН в объеме раствора в зависимости от ионного состава электролита в виде применяемых электродов[5].
Для приближенного описания изменения кислотности анолита и щелочности католита можно использовать уравнения:
в анодной зоне
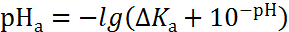 |
в катодной зоне
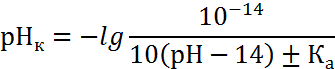 |
При применении растворимых электродов изменение рН в бездиафрагменном электролизе описывается зависимостями:
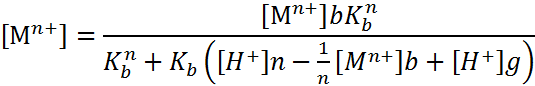 |
|
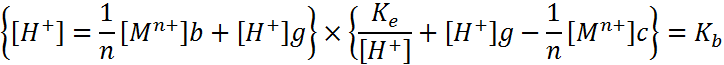 |
|
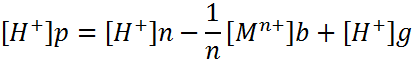 |
Решая эту систему уравнений, можно определить концентрацию [Н+]р ниже рН гидратообразования. Выше этого рН соотношение между [Мn+][OH]nnи [M(OH)n] характеризуется произведением растворимости. Для получения недиссоциирующих молекул гидроксида металла в воде указанное соотношение можно записать, используя константу нестойкости гидроксокомплексов металла КН. совместное решение новых уравнений позволяет определить [Н+]р выше рН.
Как показывают расчеты, при электролизе воды с растворимыми анодами величина рН повышается до 9,5-9,8. Однако конечное значение рН зависит не только от концентрации выделившихся ионов металла, но и от начального значения рН воды.
Введение хромат-ионов в сернокислый электролит почти не сказывается на характеристике пассивного состояния железа. Иной результат дает совместное присутствие ионов CrO4-2иClO4-. В системе 0,5 MH2SO4+ 0,001 MNaClO4 + 0,1 MNa2Cr2O7во всей области потенциалов скорость растворения снижается в 10-15 раз по сравнению со скоростью в растворе, не содержащем бихромата. Несмотря на 200-кратный избыток CrO4-2, адсорбционное вытеснение ClO4- происходит лишь в малой степени. Значительное превосходство адсорбционной способности анионов ClO4- очевидно. Та же добавка 0,1 MNa2Cr2O7 к электролитам, содержащим 0,01 М и 0,1 MNaClO4, оказывает большое влияние, так как в этих растворах активирующее действие ClO4 ослабевает. Введение 0,25MNa2Cr2O7 приводит к полному подавлению активирующего действия ClO4- в области потенциалов от 1,1 до 1,5 В, что, однако, не означает вытеснение этих анионов из пленки. 0,25MNa2Cr2O7 с добавкой 10-3MNaClO4оказывает такое же действие, как добавка102-5MNaClO4 в отсутствии хроматов. Переход к 0,1 MNaClO4 + 0,25MNa2Cr2O7приводит к полной анодной активации электрода при 1,6 В.
Отмеченное выше адсорбционное превосходство ионов ClO4- над хромат- и сульфат-ионами объясняется, по-видимому, сравнительно малой склонностью анионов ClO4- к гидратации. Энтальпии гидратации ионов ClO4-, NO3-, CrO4-2и SO42-равны соответственно2-226, -309, -967, -1016 кДж моль-1.
Трансляционные коэффициенты гидратации, показывающие средние числа молекул воды, переносимых ионами при их движении в электрическом поле, для ClO4- и SO42- составляют 0 и 0,54. Это отличие создает для ClO4--ионов значительное преимущество по сравнению с другими анионами как при вхождении в узкие поры, так и при абсорбции в оксидной пленке и адсорбции на ее поверхности. Вытеснение SO42- и замена их на ClO4- ведет, как в случаеClO4--ионов, к перезарядке поверхности пор наружного слоя Fe (III) - оксида и к появлению электрофоретического потока раствора вглубь пленки. Поверхность пор во внутреннем слое пленки сохраняет отрицательный заряд, однако величина его резко уменьшается. В результате электролит получает доступ к металлу, что и приводит к интенсивному питтингообразованию.
В процессе эволюции питтинг проходит две стадии: инициацию (зарождение) и последующее растворение металла.
На ранней стадии развития питтинга скорость растворения металла очень велика. Например, в растворе серной кислоты, содержащей хлорид калия KCl, локальная плотность анодного тока достигает десятков А×см-2.
В дальнейшем, когда питтинг становится достаточно глубоким, происходящие в нем процессы имеют много общего с процессами при щелевой коррозии.
При изучении пассивации на искусственных стоках были получены следующие результаты:
При соотношениях
| Cl-: Cr6+ : SO4-2 |
1 : 29,3 : 13,5 1 : 2929,6 : 1352,1 |
происходит сильное развитие пассивационной пленки, а при соотношении
| Cl-: Cr6+ : SO4-2 | 1 : 7,32 : 13,5 |
начинается активное растворение железа.
Стоки гальванических производств имеют, в основном, соотношение
| Cl-: Cr6+ : SO4-2 | 1 : 0,003 : 1,3 |
которое входит в рамки соотношения оптимальных показателей. Одним из лимитирующих показателей процесса является рН. В связи с тем, что рН сточных вод находится в интервале пассивации 5,8<рН<10,3, то происходит накопление диэлектрического шлама. Также важную роль играет повышение рН при электролизе сточных вод гальванического цеха. При электрохимической обработке воды значение рН возрастает от 5,5 до 5,7-6,8.
Так как плотность тока на пластинчатых электродах значительно выше, то и коэффициент растворения металла более высок. Поэтому при длительной обработке сточной воды происходит полное нарушение межстружечного пространства, что влечет за собой отключение анода. Изготовление катода из стружки ведет к конструктивным сложностям. И при этом переполюсовка электродов невозможна.
Для устранения данных проблем в электрохимическую ячейку периодически добавляли хлорид натрия NaCl в следующих концентрациях: 5, 10, 15… 40 г/л.
При времени контакта 30 сек. наиболее эффективными концентрациями хлорида были 10-20 г/л. При большем дозировании эффект пассивации не увеличивался. Интенсивное растворение диэлектрического шлама наблюдалось при увеличении времени обработки до 3-5 мин. Очевидно, что при таком времени контакта кроме электрохимического растворения металла происходило и химическое растворение.
После обработки хлоридом натрия NaCl время работы стружечного анода составляет 3 часа. Наиболее эффективное время между регенерациями – 1,5-2 часа.
Из вышеуказанного следует, что сульфат- и бихромат-ионы являются пассиваторами растворения анодов, особенно стружечных. Наиболее эффективным реагентом для растворения пассивационной пленки стружечных анодов является хлорид натрия NaCl.
Список литературы:
-
Л.Г.Спиридонова, И.А.Кулик. Особенности физико-химической очистки сточных вод различных производств.Материалы международной научно-практической конференции «Строительство-2012», ростов-на-Дону.: РГСУ, 2012
-
Culp W., Culp R., Physico-Chemical Wasterwater Treatment. New York. Van NostrandReinholgCompani, 1972
-
Грихилес М.С., Самигуллина Т.А., Сухотин А.М. Электрохимия. 1987, т. 23, № 7, стр. 979
-
Сухотин А.М. Физическая химия пассивирующих пленок на железе. – Л.: Химия, 1989, стр. 263
-
Н.Н.Гризодуб ,С.А.Воляник. Сравнительная оценка методик выбора реагентов для очистки вод. Материалы международной научно-практической конференции «Строительство-2012», Ростов-на-Дону.: РГСУ, 2012