Повышение качества и точности противоэпидемической ситуации с применением комбинированной имитационной модели на основе стохастической компартментной модели и клеточного автомата
Аннотация
Дата поступления статьи: 20.02.2014В статье рассматривается разработка моделирования пространственного распространения эпидемий для повышения качества и точности выполнения противоэпидемической с применением комбинированной имитационной модели на основе стохастической компартментной модели и вероятностного клеточного автомата. Распространение эпидемии является пространственно-распределённой динамической системой, для описания пространственно-временного поведения которой возможно применение моделей класса клеточных автоматов. Клеточные автоматы (КА) являются дискретными динамическими системами, представляющая собой совокупность одинаковых клеток, одинаковым образом соединенных между собой. Все клетки образуют, так называемую, решетку клеточного автомата. Решетки могут быть разных типов, отличаясь как по размерности, так и по форме клеток. Каждая клетка является конечным автоматом, состояния которого определяются состояниями соседних клеток. Клетки могут располагаться на одномерной прямой, плоскости или в многомерном пространстве
Ключевые слова: Клеточные автоматы, имитационное моделирование, математическая модель, эпидемическая заболевания, модель холера, динамическая система, Anylogic
05.13.01 - Системный анализ, управление и обработка информации (по отраслям)
Введение
Актуальность разработки проблемно-ориентированных систем управления ограничением эпидемических заболеваний не вызывает сомнения. Важнейшим инструментом изучения этих систем являются адекватные математические модели прогнозирования пространственного распространения эпидемий. К настоящему времени создано значительное количество таких теоретически обоснованных моделей, опирающихся на сложный математический аппарат. К общему недостатку этих моделей относят трудность применения для создания карт пространственно-временного распространения эпидемических заболеваний с учётом сложной формы географических объектов и других пространственно-определённых факторов [1].
Существующие модели распространения эпидемических заболеваний (на примере холеры) на основе компартментных моделей в условиях реализации мероприятий по активному выявлению заболевших, использующих допущение глобального перемешивания в популяции с непрерывной пространственной структурой. Модель динамики передачи холеры [2, 3], которые описывают с четырьмя состояниями для популяции и двумя состояниями для холерных вибрионов: восприимчивых к заболеванию (S); инфекционный симптоматический (Is); инфекционный бессимптомный (Ia); восстановленный (R); высоко-инфекционных холерных вибрионов (![]() ); низко-инфекционных холерных вибрионов (
); низко-инфекционных холерных вибрионов (![]() ) [4].
) [4].
Пример. Предложенная модель и сравнительный анализ на основе клеточного автомата
Предлагаемая модель состоит в использовании комбинированной имитационной модели на основе стохастических компартментных моделей и клеточных автоматов. Модель представляет собой вероятностный клеточный автомат, каждая ячейка которого представляет собой модель элементарной популяции с глобальным перемешиванием в популяции с дискретной пространственной структурой. Динамика состояния ячейки описывается стохастической компартментной моделью распространения заболевания с учётом миграционных процессов [5].
Модель миграции (Migration) представляет популяцию как множество элементарных популяций. Каждая популяция обрабатывается отдыльным процессором. Эти популяции развиваются независимо друг от друга в течение одинакового количества поколений T (время изоляции). По истечении времени изоляции происходит обмен особями между популяциями (миграция) [6]. При моделировании миграционных потоков и перемешивания популяции на основе клеточных автоматов между элементарными популяциями, которые соответствует ячейкам, происходит миграция. Отбор особей для миграции может происходить следующим образом: интенсивность миграции постоянно для всей популяции; миграция происходит из всех групп равномерно [7, 8].
Для компьютерного моделирования мы выбрали пакет AnyLogic5 [9]. Пакет предоставляет все преимущества объектно-ориентированного подхода в системной динамике [10]. В связи с этим разработанная нами собственная динамическая модель распространения холеры с использованием стандартных средств, с помощью программы Anylogic5 [11], состоит из двух элементов:
- Компартментная модель распространения холеры в популяции;
- Использование модель эффективности процесса клеточного автомата;
В описанных ниже экспериментах моделировалось развитие эпидемического процесса в популяции, с использованием предложенной модели. Начальные условия моделирования: S = 1000, Is =Ia=R = 0; Чтобы “запустить” эпидемический процесс в начальный момент времени объём группы распространителей инфекции носители бактерий виды холерных вибрионов, BH=99, BL=10. Исследование чувствительности модели к изменению коэффициента скорости миграции (М), при трех различных значениях. Сравнительный анализ компартментной и комбинированной имитационной модели, по интенсивности окрашивания в зависимости от красного цвета для получения результатов в предложенной комбинированной имитационной модели. С другой стороны синий цвет для получения результатов в компартментной модели [12].
На рис. 1 (а-в) представлены результаты исследования компартментной и комбинированной модели распространения холеры в интервале времени [0-100] лет.
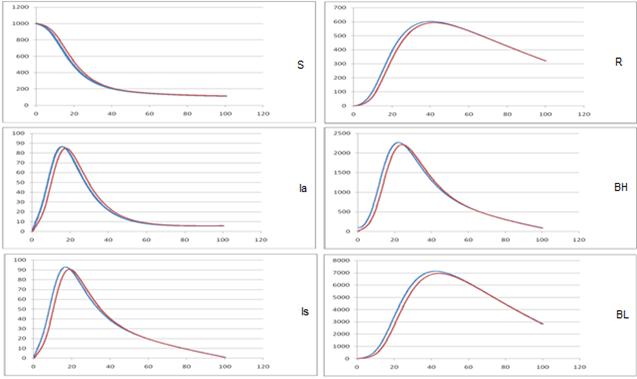
а) M = 0, 5
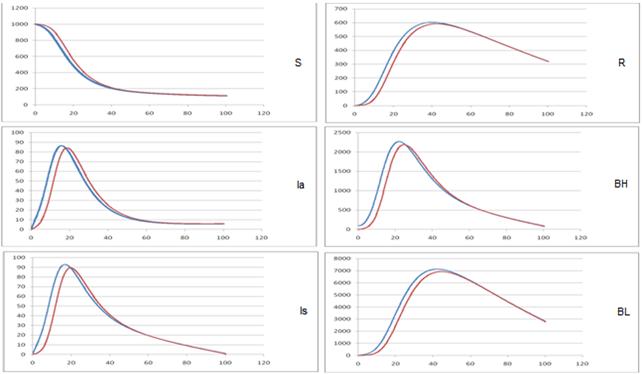
б) M = 0, 05
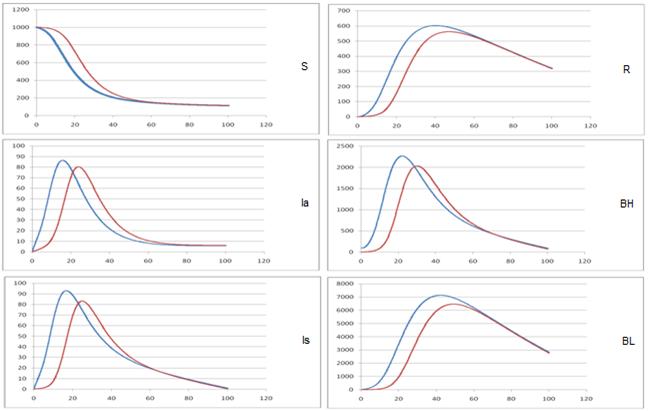
в) M = 0, 005
Рис. 1. –Исследование чувствительности модели к изменению M.
Исследование динамических свойств разработанной модели популяции необходимо как для качественной, так и для количественной оценки её адекватности. Параметры модели распространения холеры в популяции, определённые на основании информации из различных источников, очевидно, имеют различную степень точности и достоверности.
Заключение
Таким образом, можно сделать вывод о целесообразности применения клеточного автомата при моделировании распространения холеры. Как следует из графиков, значение этого параметра очень сильно влияет на характер развития моделируемого эпидемического процесса.
Результаты исследований предложенной модели показывают, что уменьшение интенсивности миграционных потоков между компартментами ведет к проявлению запаздывания изменения числа инфицированных по сравнению с моделями глобальными перемешиванием.
Предложенная модель на основе клеточного автомата способна легче интегрировать мобильность и взаимодействие между вектором и хозяином для повышения качества и точности противоэпидемической ситуации и прогнозирования эпидемических заболеваний.
Литература:
- Башабшех, М.М., Масленников, Б.И. Имитационное моделирование пространственного распространения эпидемий (на примере холеры) с применением метода клеточных автоматов с помощью программы AnyLogic//Интернет-журнал «Науковедение». 2013 №6 (19) [Электронный ресурс]. -М. 2013. – Режим доступа: http://naukovedenie.ru/PDF/135TVN613.pdf.
- Capasso and S. L. Paveri-Fontana. A Mathematical Model for the Cholera Epidemic in the European Mediterranean Region. Rev.Epidemic.Sante Publ, 1979. − p. 121-132.
- Merrell, DS, Butler, SM, Qadri, F et al. Host-induced epidemic spread of the cholera bacterium. Nature 2002. − p. 642-645.
- Nelson EJ, Harris JB, Morris JG, Jr., Calderwood SB, Camilli A (2009) Cholera transmission: The host, pathogen and bacteriophage dynamic. Nat Rev Microbiol.− p. 693–702.
- Башабшех, М.М., Масленников, Б.И., Скворцов, А.В. Комбинированная имитационная модель пространственного распространения эпидемических заболеваний по холере на основе вероятностного клеточного автомата//Интернет-журнал «Науковедение». 2013 №3 (16) [Электронный ресурс].-М. 2013. – Режим доступа: http://naukovedenie.ru/PDF/42tvn313.pdf.
- Панченко, Т.В. Генетические алгоритмы [Tekст]: Учебно-методическое пособие / под ред. Тарасевича-Астрахань. Ю.Ю. Панченко. Т.В // издательский дом "Астраханский университет" , 2007.− С.87.
- Башабшех М.М., Скворцов А.В., Масленников Б.И. Совмещение вероятностных клеточных автоматов и компартментных моделей для прогнозной оценки пространственного распространения эпидемиологических заболеваний. // Сб. Трудов НТК. Конференции: «Интеграция науки и образования-производству, экономике» , 12 декабря 2012. Tом 2. С10. Тверь.
- Башабшех М.М., Скворцов А.В., Масленников Б.И. Применение клеточных автоматов для моделирования пространственного распространения эпидемиологических заболеваний. // Вестник тверского государственного технического университета: Научный журнал. Тверь: ТвГТУ. №1, 2013. Вып.23. 9 с.
- Карпов, Ю.Г. Имитационное моделирование систем. Введение в моделирование с AnyLogic 5 [Текст] / Ю.Г. Карпов. – СПб.: БХВ-Петербург, 2006. – 400 с.
- Гаврилова З.П.Моделирование системной динамики демографической ситуации в Ростовской области [Электронный ресурс] / З.П. Гаврилова // «Инженерный вестник Дона», 2011, №1 – Режим доступа: http://www.ivdon.ru/magazine/archive/n1y2011/401 (доступ свободный) – Загл. с экрана. – Яз. рус.
- Свечкарев В.П., Олишевский Д.П. Имитационное моделирование процесса инсорсинга научно-исследовательских услуг [Электронный ресурс] / В.П. Свечкарев, Д.П. Олишевский // «Инженерный вестник Дона», 2010, №1 – Режим доступа: http://www.ivdon.ru/magazine/archive/n1e2010/174 (доступ свободный) – Загл. с экрана. – Яз. рус.
- Масленников Б.И., Математическое обеспечение информационно-аналитической медицинской системы программные продукты и системы/ Б.И. Масленников, А.В. Скворцов, международное научно-практическое приложение к международному журналу «Проблемы теории и практики управления».- 2008.- C. 158-160.