Синтез и электрохимические свойства твёрдого раствора LiMn1/3Cr1/3Fe1/3O2 со структурой α-NaFeO2
Аннотация
Дата поступления статьи: 20.02.2014Синтезирован и исследован в качестве катодного материала твёрдый раствор LiMn1/3Cr1/3Fe1/3O2 со структурой α-NaFeO2 , изоструктурный широко применяемому LiCoO2. Номинальное напряжение LiMn1/3Cr1/3Fe1/3O2 по отношению к литию составляет 4 В. Экспериментально показана возможность заряда-разряда материала до удельной емкости 220-250 мАч/г при токах С/15-С/50 без фазовых превращений.
Ключевые слова: литий-ионные аккумуляторы, катодные материалы, делафоссит, твердый раствор, рентгеностуктурный анализ, электрохимические свойства
1. Введение
Наибольшее распространение среди химических источников тока в мобильных устройствах получили литий-ионные аккумуляторы [1]. Совершенствование их требует увеличения емкости, мощности и безопасности [2, 3]. Одной из проблем на этом пути является улучшение характеристик используемых катодных материалов. Известный катодный материал LiCoO2 токсичный и дорогой. Появившиеся позже оливины LiFePO4, LiNiPO4 и шпинель LiMn2O4 имеют как преимущества, так и индивидуальные недостатки [1-5].
Кобальтит лития относится к соединениям структурного типа делафоссита [6] с общей формулой ABO2 ( A = Li, Na; B = V, Cr, Со, Fe и Ni), со слоистой структурой, в которой ионы Li+ и B3+ занимают чередующиеся плоскости (111) структуры каменной соли. При этом образуется последовательность –O–Li–O–B–O– вдоль оси c. Структурные особенности кобальтита лития при деинтеркаляции лития позволяют использовать его лишь на 50% емкости. Это стимулирует поиск твердых растворов с использованием переходных металлов [1] в позициях «B». Однако в таких твердых растворах обязательно присутствует кобальт [1, 7].
Целью данной работы является синтез и исследование электрохимических характеристик твёрдого раствора LiMn1/3Cr1/3Fe1/3O2, изоструктурного LiCoO2.
Так же следует отметить, что октаэдрические радиусы Co3+, Fe3+, Cr3+ и Mn3+ в слабом поле лигандов отличаются не более чем на 5%, что обеспечивает их взаимное замещение без искажения структуры.
2. Методика эксперимента
2.1. Приготовление образцов
Для синтеза твёрдого раствора LiMn1/3Cr1/3Fe1/3O2 был использован метод водорастворимых соединений, согласно схеме 1 (после окончательной термообработки):
½Li2CO3+⅓Fe(NO3)3+⅓Cr(NO3)3+⅓Mn(CH3CO2)2→LiMn1/3Cr1/3Fe1/3O2+… (1)
Нитраты железа, хрома и ацетат марганца растворяли в небольшом количестве воды, после чего в полученный раствор при постоянном помешивании на магнитной мешалке добавляли карбонат лития до его полного растворения. Полученный раствор выпаривали при 120 – 130оС до полного высыхания. Сухой остаток механически гомогенизировали и исследовали методом рентгеноструктурного анализа (РСА). По результатам рентгенофазового анализа обнаружен нитрат лития на фоне аморфной фазы.
Для установления температуры образования целевой фазы был проведён комплексный дифференциальный термический анализ (ДТА и ДТГ) высушенного порошка на приборе NETZSCHSTA 449 C. Результат показал, что целевой продукт начинает образовываться при температуре 800 – 850оС. На кривой ДТГ постоянство массы наблюдается после 500оС.
Синтез твёрдого раствора LiMn1/3Cr1/3Fe1/3O2 проводили в виде спрессованных таблеток диаметром 10 мм и толщиной 5 мм в муфельной печи в течение 3 часов при температуре 900 – 950°С.
2.2. Рентгенографическое исследование
Рентгеноструктурный и рентгенофазовый анализ полученных образцов
проведен с помощью дифрактометра ARL-X’TRA методом Брегга-Брентано
(θ - 2θ) с шагом сканирования 0,02°. Время экспозиции на каждом шаге 1с. Использовано излучение CuKα − анода с длиной волны 1,5406 Å. Точность измерения параметров составила 0,003 Å. Обработка данных выполнена с использованием полнопрофильного анализа методом Ритвелда.
2.3. Электронная микроскопия
Изучение микроструктуры материалов осуществлялось на растровом электронном микроскопе Zeiss Supra 25.
2.4. Электрохимические испытания
Для проведения электрохимических исследований предварительно полученный твёрдый раствор смешивался с токопроводящим агентом в виде сажи и связкой (фторопласт Ф-2М в растворе 1-метил-2-пирролидон) в процентном весовом соотношении 88:10:2.
Полученная паста была нанесена тонким слоем на предварительно подготовленную алюминиевую подложку и высушена при 100°С в течение 1 часа. Электрохимическое исследование проводилось в гальваностатическом режиме при стабилизированном токе заряда-разряда в трёхэлектродной ячейке с использованием мультифункционального реле времени NOVATEK-ELECTRO R-201M и мультиметра APPA 207. Электролитом служил 1,2М раствор LiPF6 в смеси этиленкарбоната и диметилкарбоната (1:1). Рабочим электродом сравнения был металлический литий. Сборка ячейки осуществлялась в перчаточном боксе в атмосфере сухого углекислого газа с точкой росы около − 50°С.
3. Результаты и их обсуждение
3.1. Рентгенографическое исследование
Исследование методами рентгенфлюоресцентного анализа (РФА) показало, что полученный продукт представляет твёрдый раствор, изоструктурный LiCoO2, с примесями в виде LiMn2O4 (не более 10%) и Li2CrO4 (не более 5%). Наличие указанных примесей можно объяснить тем, что при синтезе протекают три параллельные реакции. Реакция синтеза целевой фазы (1), реакция образования LiMn2O4, связанная с избыточным окислением Mn(II) до Mn(IV) вместо Mn(III) (2), и реакция окисления Cr(III) до Cr(VI) в присутствии ионов щелочного металла (3).
Li2CO3 + 4Mn(CH3CO2)2 + 9O2 →2LiMn2O4 + 12H2O + 17CO2(2)
Li2CO3 + Cr(NO3)3 → Li2CrO4 + 3NO2 +CO2 (3)
Реакции (2) и (3) являются вторичными и нежелательными. Однако, поскольку был использован метод активных прекурсоров, в котором достигается достаточно хорошая гомогенизация компонентов на наноуровне, то, вероятно, взаимодействие при термообработке происходит преимущественно по схеме реакции (1).
РСА целевого продукта был проведён с использованием программного пакета FullProf 2013. Для уточнения структуры были использовано 16 параметров и гауссовская форма пика, а именно 6 параметров, относящихся к структуре, и 10 профильных параметров. Значения параметров после уточнения приведены в табл. № 1 в сравнении с кобальтитом лития [8], значения профильного R-фактора составило 14 %.
Таблица № 1
Сравнение параметров кобальтита лития и синтезированного LiMn1/3Cr1/3Fe1/3O2, изоструктурного LiCoO2
|
|
LiMn1/3Cr1/3Fe1/3O2 |
LiCoO2 |
|
Пространственная группа |
R-3m, № 166 |
R-3m, № 166 |
|
a=b, Å |
2,892 |
2,817 |
|
c, Å |
14,313 |
14,052 |
|
V, Å3 |
103,668 |
96,57 |
|
c/a |
4,949 |
4,988 |
|
Число формульных единиц |
3 |
3 |
|
z(O2−) |
0, 2138 |
0,2538 |
Как видно из данных табл. № 1, полная замена ионов кобальта в позициях «B» приводит к увеличению объема ячейки на 6,8%, что можно объяснить наличием структурных дефектов. Этот факт требует дальнейшего изучения. Следует также отметить, что ионы железа, хрома и марганца распределены в позиции «B» неупорядоченно, так как сверхструктурные дифракционные отражения на дифрактограмме не обнаруживаются (рис. 1), а их факторы заселённости соответствуют индексам данного катиона в соответствующей молекулярной формуле.
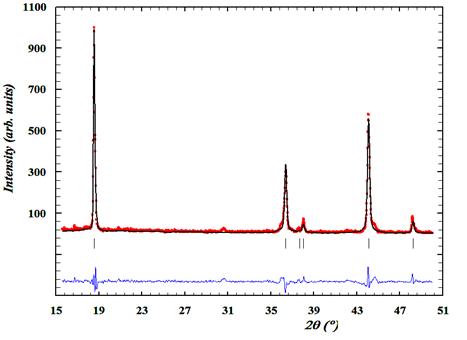
Рис. 1. – Фрагмент рентгенограммы LiMn1/3Cr1/3Fe1/3O2 с разностным профилем
На рис. 2 показана слоистая структура полученного твёрдого раствора LiMn1/3Cr1/3Fe1/3O2со структурой α–NaFeO2. Из анализа структуры твёрдого раствора LiMn1/3Cr1/3Fe1/3O2 можно считать, что она относится к О3-слоистым структурам с двумерными плоскостями для миграции ионов лития, что должно обеспечивать хорошие электрохимические свойства [8].
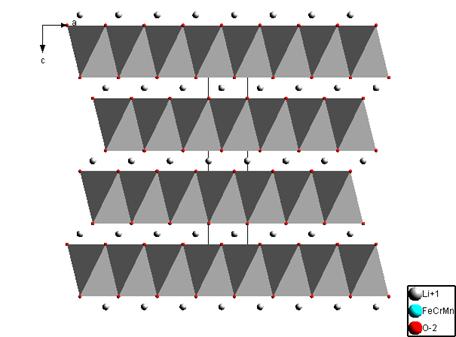
Рис. 2. – Структура LiMn1/3Cr1/3Fe1/3O2 (полиэдрами показан остов BО2)
3.2. Электронная микроскопия
Исследования с помощью растровой электронной микроскопии (РЭМ) поверхности образца LiMn1/3Cr1/3Fe1/3O2 в виде спечённой керамики показали наличие пластинчатой текстуры (рис. 3). Характерный размер наблюдаемых частиц приблизительно 0,5 мкм.

Рис. 3. – Электронная микрофотография поверхности керамики образца LiMn1/3Cr1/3Fe1/3O2
3.3. Электрохимические испытания
Электрохимические исследования катодного материала LiMn1/3Cr1/3Fe1/3O2 показывают его возможность к циклированию в диапазоне напряжений 2,8 − 4,5 В в гальваностатическом режиме при токах С/15 – С/30 до разрядно-зарядной ёмкости 220 − 230 мАч/г, что составляет 75−80% от теоретической ёмкости (285 мАч/г) и при токах С/50 до глубины разряда-заряда 250 мАч/г. Заряд на большую глубину ограничен устойчивостью электролита при напряжении более 4,5 В. В разряженном состоянии ЭДС системы LiMn1/3Cr1/3Fe1/3O2 – литий составляет 3,7 В, а при степени заряда 75 − 80 % после релаксации ячейки в течение 24 часов (для уменьшения влияния поляризации) − 4,2 В. Процесс заряда катода, связанный с изменением степеней окисления переходных элементов при деинтеркаляции ионов лития, можно описать уравнением (4), разряд идёт в противоположном направлении:
LiMn1/3Cr1/3Fe1/3O2 → xLi+ + Li1–xMn1/3Fe1/3Cr1/3O2 + xē (4)
Из анализа изменения напряжения во время циклирования можно заметить отсутствие плато при заряде-разряде (рис. 4.), что в свою очередь указывает на то, что процесс внедрения и извлечения лития проходит однофазно и без изменения структурных фаз [9] с образованием Li1-xMn1/3Cr1/3Fe1/3O2.
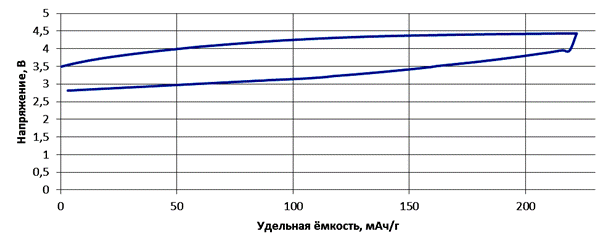
Рис. 4. – Цикл заряда-разряда LiMn1/3Cr1/3Fe1/3O2
Данный факт положительно сказывается на электрохимических характеристиках, в отличие от LiFePO4, в котором при циклировании происходит двухфазный процесс, и образование новой фазы на поверхности частицы затрудняет диффузию ионов лития.
Сравнение электрохимических свойств LiMn1/3Cr1/3Fe1/3O2 с другими катодными материалами приведено в табл. № 2. Как видно из сравнения (табл. 2), описанный в статье катодный материал LiMn1/3Cr1/3Fe1/3O2 на данный момент уступает по предельно допустимым токам заряда-разряда современным катодным материалам, однако имеет одну из наибольших удельных ёмкостей и может применяться для длительного питания различных электронных и электротехнических устройств.
Таблица № 2
Сравнительная характеристика электрохимических свойств LiMn1/3Cr1/3Fe1/3O2 с некоторыми материалами
Формула |
Удельная ёмкость |
ЭДС |
Максимальный |
|
LiMn1/3Cr1/3Fe1/3O2 |
230 |
4,0 |
До 0,1С |
|
LiCoO2 |
140 |
3,7 |
До 2С |
|
LiFePO4 |
150 |
3,3 |
До 4С |
|
LiMn1/3Ni1/3Co1/3O2 |
220 |
4,2 |
До 2С |
|
LiMn2O4 |
100 |
4,0 |
До 20С |
Выводы
Синтезирован новый твердый раствор LiMn1/3Cr1/3Fe1/3O2 со структурой слоистого α–NaFeO2. Показана перспективность его использования в качестве катодного материала для литий-ионных аккумуляторов. Удельная ёмкость LiMn1/3Cr1/3Fe1/3O2 при токах от 0,1С до 0,02С составляет 220 – 250 мАч/г.
Литература:
- Whittingham M.S. Lithium Batteries and Cathode Materials [Text] // Chem. Rev. 2004, − V. 104. − № 10. − Р. 4271 − 4301.
- Фиговский, О. Новейшие нанотехнологии. [Электронный ресурс] //«Инженерный вестник Дона», 2012, № 1. – Режим доступа: http://ivdon.ru/magazine/archive/n1y2012/725 (доступ свободный) – Загл. с экрана. – Яз. рус.
- Положенцев, О.Е., Шаповалов, В.В., Гуда, А.А., Подковырина, Ю.С., Чайников. А.П., Бугаев, А.Л., Сухарина, Г.Б., Поль, А., Солдатов, А.В. Динамика наноразмерной атомной структуры новых наноструктурированных конденсированных материалов для возобновляемых источников тока на основе нанокомпозита V2O5/Fe/LiF в цикле зарядка-разрядка. [Электронный ресурс] // «Инженерный вестник Дона», № 4 (часть 2). – Режим доступа: http://www.ivdon.ru/magazine/archive/n4p2y2012/1465 (доступ свободный) - Загл. С экрана. – Яз. Рус.
- Padhi A.K., Nanjundaswamy K.S., Goudenough J.B. Phospho-olivines as Positive-Electrode Materials for Rechargeable Lithium Batteries [Text] // Journal of Electrochemical Society, 1997. − V. 144 − Р. 1188 − 1194.
- Okada S., Sawa S. , Egashira M., Yamaki J., Tabuchi M., Kageyama H., Konishi T., Yoshinof A. Cathode properties of phospho-olivine LiMPO4 for lithium secondary batteries [Текст] // Journal of Power Sources, 2001. − V. 97 − 98. − Р. 430 − 432.
- Koksbang R., Barker J., Shi H., Saidi M.Y. Cathode materials for lithium rocking chair batteries [Text] // Solid State Ionics, 1996. −V. 84. −№ 1.− Р. 1 − 21.
- Barboux P., Shokoohi F.K., Tarascon J.-M. Method for preparation of LiMn2O4 intercalation compounds and use thereof in secondary lithium batteries [Text] // Bell Communications Research, Inc. 1992 US Patent US 5135732 A.
- Безносиков, Б.В., Александров, К.С. Кристаллы семейства делафоссита. [Text]: Препринт № 843 Ф / Б.В. Безносиков. – Красноярск: институт физики им. Л.В. Киренского СО РАН, 2007. − 32 с.
- Ellis B.L., Town K., Nazar L.F. New composite materials for lithium-ion batteries [Text] // Electrochimica Acta, 2012. − V. 84. − Р. 145 − 154.
- Nazri, G.-A., Pistoya, G. Lithium batteries. Science and technology [Text] / G.-A. Nazri. – New York: Springer, 2009. − 709 p.
- Фундаментальные проблемы преобразования энергии в литиевых электрохимических системах [Текст] // Материалы XII Международной конференции «Фундаментальные проблемы преобразования энергии в литиевых электрохимических системах» / под ред. В.В. Галкина. – Краснодар: Кубанский гос. ун-т, 2012. – 326 с.
- Фундаментальные проблемы электрохимической энергетики: Сборник материалов XII Международной конференции «Электрохимическая энергетика» / под ред. И.А. Казаринова. – Саратов: Изд-во Сарат. ун-та, 2011. – 554 с.: ил.